
应用简介
肿瘤细胞通过膜表面特定受体与基质或基底膜的层粘连蛋白、纤维连接蛋白和IV型胶原等相粘连,然后肿瘤细胞可释放蛋白水解酶或激活基质中已存在的酶原,使基质成分降解,最后肿瘤细胞运动而充填到被水解了的基质的空隙处,如此三个过程不断重复肿瘤细胞不断向深层侵袭。
技术原理
本实验采用的Matrigel是从小鼠EHS肉瘤中提取的基质成分,含有LN、IV型胶原等。将Matrigel铺在Transwell侵袭小室的多孔滤膜上,能形成与天然基底膜极为相似的基底膜结构。具有侵袭能力的细胞在趋化剂诱导下可穿过多孔滤膜,侵袭细胞经染色后,在显微镜下观察和计数。
实验方法
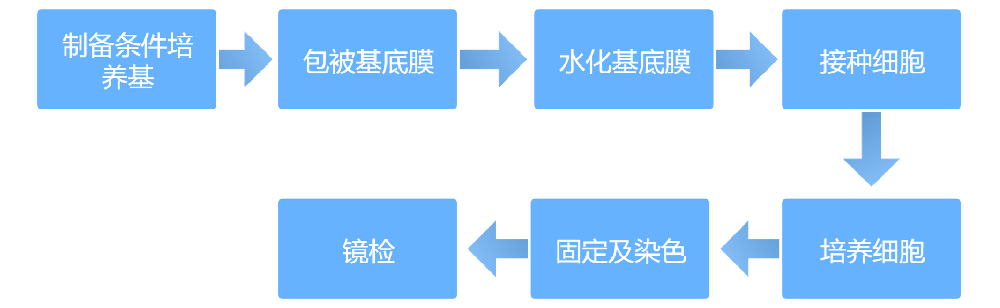
注意事项
1、照相前一定要晾干,照相时将小室正置于载玻片上,在倒置显微镜下观察、照相。
2、使用Matrivgel前应从-20℃转移至4℃待其自然溶化(如过夜放置),避免反复冻融。
3、使用时需接触Matrivgel的试管、移液吸头等均应预冷于4℃。
4、使用Matrivgel时注意无菌操作。
细胞侵袭实验关键在于模拟体内微环境并保证数据准确。铺胶时,Matrigel 基质胶需提前预冷并置于冰上操作,按比例稀释后均匀铺于 Transwell 小室,避免气泡产生,37℃孵育待胶凝固,形成致密的细胞外基质模拟屏障。
接种细胞时,调整细胞密度至关重要,过高易因营养竞争干扰侵袭,过低则导致数据误差,建议每小室接种 1-5×10?个细胞;同时需注意控制小室上、下腔培养液的成分差异,下腔添加含血清或趋化因子的培养基,以形成有效的趋化梯度,吸引细胞定向迁移。
实验结束后,固定、染色过程需轻柔操作,防止小室膜上细胞脱落,选用棉签小心擦除未侵袭细胞,确保染色仅呈现穿过膜的细胞;显微镜观察时,需在多个视野下计数并取平均值,避免主观误差。此外,设置阳性和阴性对照,如使用已知侵袭能力强的细胞系作阳性对照,验证实验体系有效性。


